眼科重磅单品CBT-001海外权益落地,远大医药前瞻布局大中华区权益价值凸显
近日,国际临床眼科药物公司Cloudbreak Pharma Inc.(拨康视云)与日本眼科企业参天制药株式会社公布了一项重要的产品授权协议,拨康视云以9,100万美元(约合超6.5亿人民币)的首付款及里程碑付款,将其用于治疗翼状胬肉的多激酶抑制剂CBT-001在包括日本、韩国、越南、泰国、马来西亚、菲律宾、新加坡和印度尼西亚等东南亚地区的开发、生产与商业化权利授予参天制药。
CBT-001为已上市治疗肺纤维化药物尼达尼布的创新改良产品,对新生血管生成和组织纤维化均有抑制作用,可抑制翼状胬肉生长并控制病情恶化。早在2020年,国内在眼科领域深耕多年的远大医药(0512.HK)便已前瞻性地布局了这一重磅单品,公司以总计7,450万人民币的首付款和里程碑付款斩获了CBT-001在中国大陆、中国香港、中国澳门、中国台湾的独家生产和商业化权利,并以563万美元认购了拨云开曼约6.5%的股份,同时获取后者的一个董事席位。
填补翼状胬肉治疗市场空白,CBT-001有望重塑治疗标准
翼状胬肉为一种眼表良性增生性疾病,主要特征是生长在角膜边缘上呈翼状纤维血管的结膜组织。由于其损伤角膜,可导致视力障碍。虽然翼状胬肉生长在巩膜,但其顶端会侵入角膜引起明显的眼部症状,包括充血、刺激、疼痛和异物感,从而影响患者的生活,且具有复发倾向和非转移性。
拨康视云于今年4月在美国波士顿举行的美国白内障和屈光手术学会(ASCRS)年度会议上分享的数据显示,超过一半的受访翼状胬肉患者表示环境因素会加重他们的症状,使他们很难在户外度过时间;同时患者也反馈了与空调相关的不适,因此在室内环境也可能带来挑战。翼状胬肉在美国影响着约1,500万人。另有数据显示,我国已有近9,000万翼状胬肉患者。
然而,市场上目前尚无批准的针对该病症的治疗性药物,临床常用人工泪液和短期局部眼用类固醇辅助治疗,但相关产品未经过临床试验认证,存在一定的用药风险。部分中度至重度翼状胬肉的患者可能会寻求手术干预,但仅切除病灶并不能完全防止复发,且存在引发无可纠正的视力问题、眼红和刺激感等负面影响。
与紧缺的针对性药物相对的是庞大的用药需求。据拨康视云招股书显示,全球治疗翼状胬肉药物的市场规模预计将于2027年达到2.73亿美元,于2032年达到25.29亿美元,复合年增长率为56.0%。中国治疗翼状胬肉药物的市场规模预计于2027年达到2.18亿美元,于2032年达到20.22亿美元,复合年增长率为56.1%。
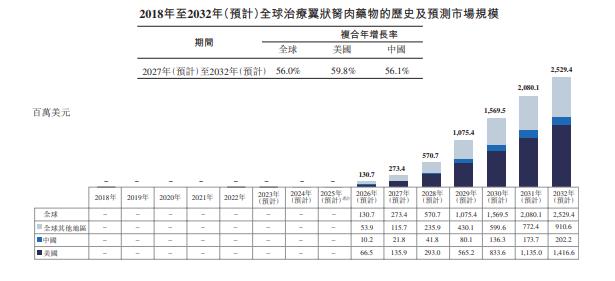
图片来源:拨康视云招股书
在此背景下,CBT-001这一革命性的翼状胬肉眼科药物应需而生。据悉,作为一种多激酶抑制剂,CBT-001直接针对翼状胬肉的发病根源——血管生成和纤维化过程进行干预,从而减少和推迟手术的切除的需要,实现了对翼状胬肉传统治疗方式的突破。
目前,CBT-001正在美国、中国、澳洲、新西兰和印度开展大规模的全球多中心III期临床试验。且根据远大医药相关公告,CBT-001已在美国完成的II期临床试验显示,该产品安全性高,临床疗效显著;目前CBT-001已在中国获批开展III期临床研究。
值得一提的是,CBT-001目前是全球范围内进展最快的翼状胬肉治疗药物。全球范围内仅有3款适用于预防翼状胬肉生长及减少结膜充血的临床阶段候选药物,其中两款处于II期临床试验阶段,CBT-001是唯一处于三期临床试验阶段的药物。若未来CBT-001成功获批,其将填补当前翼状胬肉治疗市场的空白,成为翼状胬肉的首要治疗选择之一,或将重塑治疗翼状胬肉的全球标准。
庞大的市场空间,叠加目前CBT-001在全球范围内进展最快的优势,CBT-001未来巨大的市场潜力可以预见。
深耕布局夯实眼科龙头地位,创新引领打造产品护城河
本次CBT-001海外权益的落地不仅体现了该产品价值获得了日本专业眼科企业的认可,同时也体现了前瞻性布局该产品大中华区权益的远大医药的战略投资眼光,而这也与公司在眼科领域深厚的产品及经验积累息息相关。
事实上,远大医药在眼科领域已积累了十余年的发展经验,公司是我国主要的眼科药研发、生产及销售综合企业之一,并于业内率先提出打造集“预防+治疗+保健”的“大五官生态圈”理念。产品管线方面,远大医药眼科在售产品管线数量位居行业前列,公司不仅手握疗效及商业化表现双佳的拳头产品(如国内治疗干眼症的一线用药瑞珠,以及国家中药保护品种和血明目片等),还有一系列在研创新产品储备,产品梯队建设齐全完备。
图片来源:远大医药官微
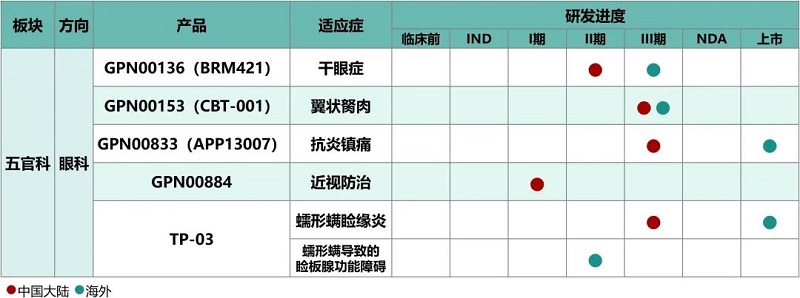
远大医药以未被满足的市场需求为创新产品布局方向,针对“近视”、“干眼症”、“翼状胬肉”、“眼科术后抗炎镇痛”、“蠕形螨睑缘炎”和“蠕形螨导致的睑板腺功能障碍”等患病人数庞大或是尚缺乏针对性药物的病症储备了5款创新产品。。
具体来看,公司用于治疗干眼症的小分子多肽药物GPN00136已于2023年4月获批在中国开展II期临床研究。
干眼症作为全球常见疾病之一,全球各国干眼症发病率为5.5%-33.7%,我国干眼症发病率为21%-30%,显著高于欧美发达国家。GPN00136在美国完成的II期临床数据显示,该产品安全性较高且刺激性小,有能够在2周内迅速缓解干眼症症状和体征的潜力,未来若GPN00136成功获批上市,将有望改写当前干眼症药物市场竞争格局。
GPN00833是用于抗炎镇痛的激素纳米混悬滴眼液,该产品在中国的III期临床试验于2023年10月完成首例患者入组给药,并于今年3月获得美国FDA批准上市。值得注意的是,GPN00833为首款获得美国FDA批准的丙酸氯倍他索眼科药物,也是15年来首个获批的激素类纳米制剂。
目前激素眼用制剂是治疗眼部炎症最常用且最有效的药物之一,但目前我国激素眼用制剂由进口产品主导,该细分市场近十年无新产品上市。已被验证的安全性以及有效性优势有望助力GPN00833打破这一局面,而相应的,该产品未来的销售潜力亦十分可观。
此外,远大医药近期布局的用于治疗蠕形螨睑缘炎及蠕形螨导致的睑板腺功能障碍的全球创新眼用制剂TP-03产品进展也十分顺利,该产品于2023年7月获得美国FDA批准上市,是目前FDA批准的首款也是唯一一款针对蠕形螨睑缘炎的药物,并已于2023年10月在中国完成了III期临床研究。
睑缘炎是一种常见的眼科疾病。蠕形螨睑缘炎是蠕形螨感染睑缘所致的慢性炎性反应性疾病,约占所有睑缘炎病例的三分之二以上。蠕形螨也是睑板腺功能障碍的危险因素之一,蠕形螨导致的睑板腺功能障碍患者常出现眼睑边缘发炎和视力模糊,并可能导致睑板腺堵塞和/或睑脂液分泌的减少,若不及时接受治疗,可能会导致泪膜永久性改变和进行性腺体丧失。
根据弗若斯特沙利文数据,2021年全球蠕形螨睑缘炎的患者人数已有约4.68亿人;预计到2030年全球患者将达约5.06亿人,其中中国患者约5,980万人。数据显示,美国蠕形螨性睑缘炎影响着约2,500万眼部护理患者,即每12名成人中就有1名蠕形螨性睑缘炎患者。中国患者规模是美国患者的1倍多,同时,我国还有近7,000万睑板腺功能障碍患者,相应临床需求十分可观。目前我国并没有针对蠕形螨睑缘炎的药物上市,远大医药TP-03未来也有望填补这一临床空白,为蠕形螨睑缘炎患者带来新的治疗选择。
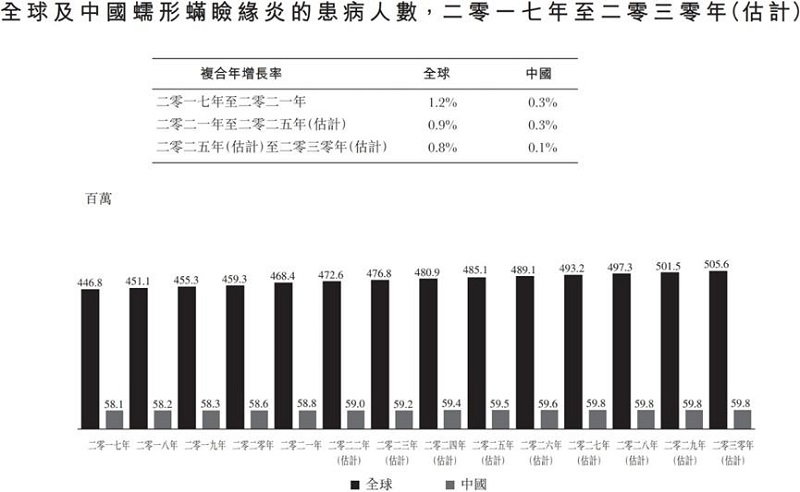
数据来源:弗若斯特沙利文
从远大医药的创新布局不难看出,公司已在眼科板块成功地落实了其差异化创新的战略布局。这些创新成果不仅提升了远大医药在该领域的核心竞争力,未来也有望为广大患者提供更多、更好的治疗选择。
在以核心产品为支撑,创新产品不断推进研发进展的产品格局下,远大医药已经稳居我国眼科用药企业的第一梯队,同时,公司在创新产品研发的表现已获得了市场的认可,随着眼科领域各重磅创新单品研发的持续推进,未来也有望为公司该板块的增长持续提供新的动力。
本文来源:IBN.CN。版权声明
除原创文章外,本文仅代表原作者观点,不代表本站立场。
本站授权文章可转载,转载可标明出处。



